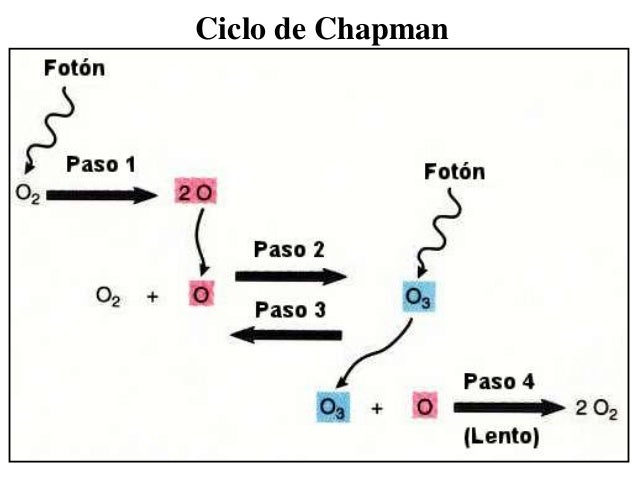
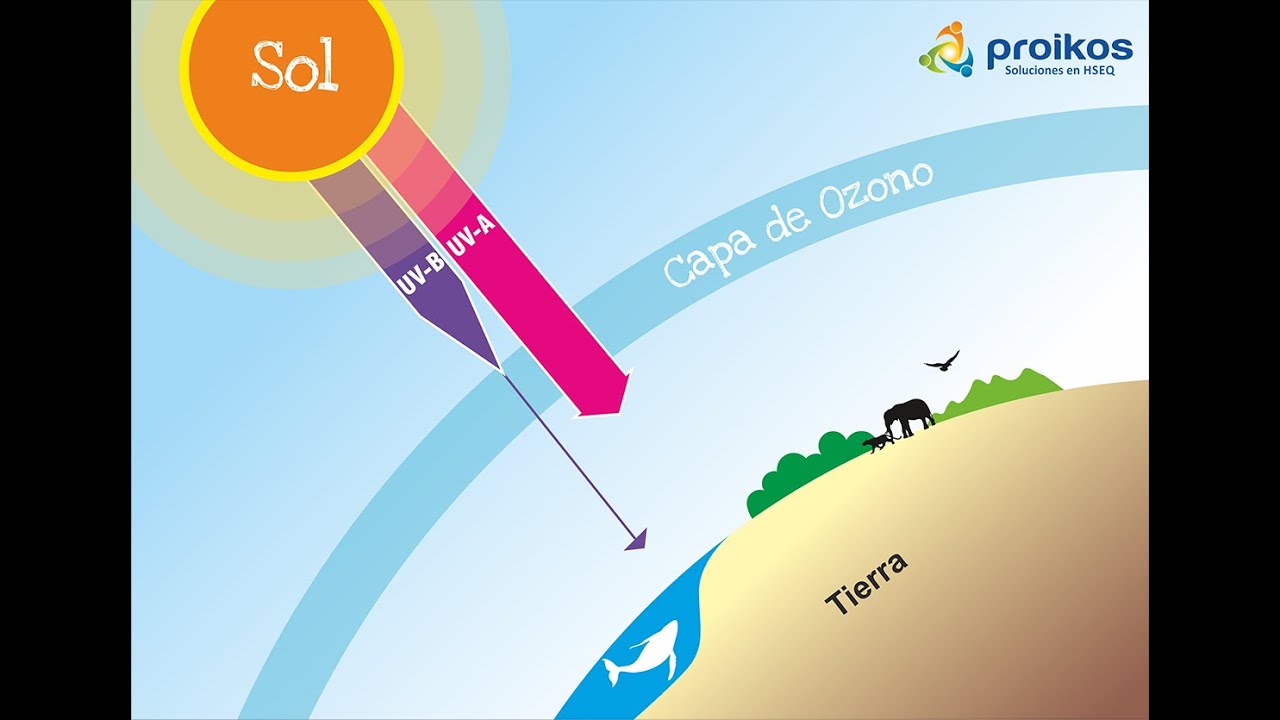
Toda materia, sustancia, o sus combinaciones, compuestos o
derivados químicos y biológicos, (humos, gases, polvos, cenizas, bacterias,
residuos, desperdicios y cualquier otro elemento), así como toda forma de
energía (calor, radiactividad, ruido), que al entrar en contacto con el aire,
el agua, el suelo o los alimentos, altera o modifica su composición y
condiciona el equilibrio de su estado normal.
Sustancia no deseada, que está presente en cualquier medio,
impidiendo o perturbando la vida de los organismos y/o produciendo efectos
nocivos a los materiales y al propio ambiente.
Elemento que al actuar en el ambiente lo modifica
negativamente.
Se reconocen dos tipos de contaminantes:
Los no biodegradables, llamados así porque no se descomponen
o lo hacen muy lentamente, tales como recipientes de vidrio, plástico, latas,
el D.D.T., Malatión, y otros; los contaminantes biodegradables, que se
descomponen con relativa rapidez o facilidad: Aguas negras (aguas cloacales),
algunos tipos de detergentes y los restos orgánicos.
Es toda forma de materia o energía capaz de alterar,
interferir o modificar en forma negativa a los elementos del ambiente siendo en
consecuencia posible factor de riesgo para el hombre y otros seres vivos.
Principales contaminantes
Óxidos de carbono: Corresponden al dióxido de carbono (CO2)
y monóxido de carbono (CO) compuestos originados en la combustión de los
combustibles que contienen carbono.
· El CO2 se libera de combustiones completas
· El CO se forma cuando el combustible se quema en escasa
cantidad de oxígeno. Este gas es incoloro, inodoro e insípido, por lo que suele
pasar inadvertido; aun así, resulta mortal si se encuentra en concentraciones
elevadas.
Óxidos de azufre: Se producen al quemar azufre o
combustibles que lo contienen, como el carbón y el petróleo. El más importante
de éstos es el dióxido de azufre (SO2), que luego se oxida en la atmósfera,
formando trióxido de azufre (SO3).
Los SOx son irritantes que afectan es sistema respiratorio
del hombre. También provocan daños en la calidad y rendimiento de las cosechas
y participan directamente en la formación de la lluvia ácida.
Óxidos de nitrógeno: Se forman a partir de los procesos de
combustión que ocurren en presencia de aire, especialmente en los motores de
los medios de transporte. Debido al calor producido por la fuente de combustión
(bencina), el nitrógeno atmosférico reacciona con el oxígeno, formando varios
compuestos diferentes. Entre ellos están el monóxido de nitrógeno (NO) y el
dióxido de nitrógeno (NO2), un gas de olor agradable y que irrita fuertemente
el sistema respiratorio.
Hidrocarburos: Son compuestos formados por carbono e
hidrógeno que por lo general se liberan de la volatilización de combustibles
como la gasolina. Su peligrosidad radica en que son capaces de reaccionar en la
atmósfera, generando otras sustancias aún más nocivas. Investigaciones
confirman que algunos RH son cancerígenos, es decir, pueden provocar cáncer.
Ésta es contaminación biológica somos los causantes de estas
contaminaciones.
Son organismos o restos de organismos que afectan la calidad
del aire en espacios cerrados. Algunos de ellos pueden deteriorar las
superficies, no sólo en interiores sino también al aire libre. Estos
contaminantes se desplazan a través del aire y son a menudo invisibles. Entre
los más comunes podemos mencionar las bacterias, el musgo, los mohos, la caspa
de mascotas, la saliva de los gatos, los ácaros del polvo, las cucarachas y el
polen. Las siguientes son algunas de las muchas fuentes de las que provienen
estos contaminantes: · Las bacterias son transportadas por el hombre, los
animales, el suelo y los restos vegetales. · Los virus se transmiten a través
del hombre y los animales · El polen proviene de las plantas · La proteína de
la orina de las ratas y ratones es un poderoso alérgeno. Una vez seca puede
entrar en suspensión. Las dos condiciones que deben cumplirse para favorecer la
actividad de los contaminantes biológicos son la presencia de nutrientes y
humedad. Dichas condiciones pueden darse en lugares tales como cuartos de baño,
sótanos húmedos o inundados, humidificadores y acondicionadores de aire y
cierto tipo de alfombras y mobiliario. El musgo, los mohos y otros
contaminantes biológicos se desarrollan en los sistemas de aire acondicionado
central, desde los cuales se distribuyen por todo el hogar.
Los contaminantes físicos son caracterizados por un
intercambio de energía entre persona y ambiente en una dimensión y/o velocidad
tan alta que el organismo no es capaz de soportarlo.
Por varios razones el contaminante físico que más que otros
está relacionado con la geología ambiental es la radiactividad (natural o
artificial).
La radioactividad natural puede generar problemas
ambientales por ejemplo en la cercanía de yacimientos de Uranio (y otros
minerales radioactivos).
Las distintas aplicaciones de sustancias radioactivas en
ciencia, técnica y en la producción de energía y también el uso militar generan
cantidades considerables de desechos radioactivos.
La búsqueda y la habilitación de lugares seguros para el
almacenamiento definitivo de este tipo de deshecho es una problema para cada
país que utiliza sustancias radioactivas para fines civiles o militares. El
aspecto geológico de la solución de este problema forma parte de la geología
ambiental.
Podemos
encontrar dos tipos de contaminantes, según si han sido emitidos directamente a
la atmósfera o si se han formado en ella.Así distinguimos: contaminantes
primarios y contaminantes secundarios.
Los
contaminantes primarios:son aquellas sustancias que son vertidas directamente a
la atmósfera desde los focos contaminantes.Como consecuencia de diferentes
actividades,ya sean humanas o de origen natural.
EJEMPLOS: Monóxido de carbono(CO), el dióxido de carbono(CO2) o el metano(CH4).
Por otro lado
los contaminantes secundarios son aquellos que se originan en el aire,a través
de reacciones químicas o fotoquímicas, por la interacción entre los
contaminantes primarios o por sus reacciones con los componentes naturales de
la atmósfera.
EJEMPLOS: El
NO2, que se forma cuando se combina NO con oxígeno en el aire, también
encontramos el nitrato peroxoacetileno (PAN) -HCO2+ NO2 - y hidrocarburos (HC).